Описание
Для водородной связи необходимо наличие двух полярных ковалентных связей, в образовании одной из которых участвует атом водорода, несущий эффективный положительный заряд, а другой — электроотрицательный атом (кислород, азот, галоген) с эффективным отрицательным зарядом. Как правило, водородная связь играет решающую роль в межмолекулярном взаимодействии, хотя известны и многочисленные примеры внутримолекулярных водородных связей (например, в белках). Водородная связь считается ключевым взаимодействием в супрамолекулярной химии. Она определяет структуру белков, двойной спирали ДНК (рис. 1), воды и льда, супрамолекулярных ансамблей, полимеров, а также оказывает влияние на свойства многих растворов.
Энергия водородной связи меняется в широких пределах от 5 до 100 кДж/моль, однако обычно водородная связь намного слабее ковалентной связи (рис. 2). В зависимости от энергии, водородная связь имеет различный характер: от чисто электростатического (слабая связь) до преимущественно ковалентного (сильная связь).
Иллюстрации

|
Рис. 1. Водородные связи между азотистыми основаниями, определяющие структуру ДНК.
|
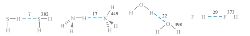
|
Рис. 2. Сравнение энергий водородных и ковалентных связей (в кДж/моль).
|
Автор
- Еремин Вадим Владимирович
Источник
- Стид Дж. В., Этвуд Дж.Л. Супрамолекулярная химия. Т. 1. — М.: Академкнига, 2007. — 480 с.
