Описание
Традиционная химия основана на ковалентных связях между атомами. В то же время для синтеза сложных наносистем и молекулярных устройств, используемых в нанотехнологиях, возможностей одной ковалентной химии недостаточно, ведь такие системы могут содержать несколько тысяч атомов. На помощь приходят межмолекулярные взаимодействия — именно они помогают объединить отдельные молекулы в сложные ансамбли, называемые супрамолекулярными структурами.
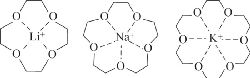
Простейший пример супрамолекулярных структур — это комплексы типа «хозяин–гость». Хозяином (рецептором) обычно выступает большая органическая молекула с полостью в центре, а гостем — более простая молекула или ион. Например, циклические полиэфиры различного размера (краун-эфиры) довольно прочно связывают ионы щелочных металлов (рис. 1).
Для супрамолекулярных структур характерны следующие свойства.
1. Наличие не одного, а нескольких связывающих центров у хозяина. В краунэфирах эту роль выполняют атомы кислорода, обладающие неподеленными электронными парами.
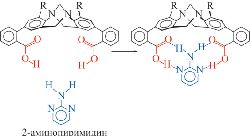
2. Комплементарность: геометрические структуры и электронные свойства хозяина и гостя взаимно дополняют друг друга. В краун-эфирах это проявляется в том, что диаметр полости должен соответствовать радиусу иона. Комплементарность позволяет хозяину осуществлять селективное связывание гостей строго определенной структуры. В супрамолекулярной химии это явление называют «молекулярным распознаванием» (англ. — molecular recognition) (рис. 2).
3. Комплексы с большим числом связей между комплементарными хозяином и гостем обладают высокой структурной организацией.
Супрамолекулярные структуры очень широко распространены в живой природе. Все реакции в живых организмах протекают с участием ферментов — катализаторов белковой природы. Ферменты — идеальные молекулы-хозяева. Активный центр каждого фермента устроен таким образом, что в него может попасть только то вещество (субстрат), которое соответствует ему по размерам и энергии; с другими субстратами фермент реагировать не будет. Другим примером супрамолекулярных биохимических структур служат молекулы ДНК, в которых две полинуклеотидные цепи комплементарно связаны друг с другом посредством множества водородных связей. Каждая цепь является одновременно и гостем, и хозяином для другой цепи.
Основные типы нековалентных взаимодействий, формирующих супрамолекулярные структуры: ионные, ион-дипольные, ван-дер-ваальсовы, гидрофобные взаимодействия и водородные связи. Все нековалентные взаимодействия слабее ковалентных — их энергия редко достигает 100 кДж/моль, однако большое число связей между хозяином и гостем обеспечивает высокую устойчивость супрамолекулярных ансамблей. Нековалентные взаимодействия слабы индивидуально, но сильны коллективно.
Формирование супрамолекулярных ансамблей может происходить самопроизвольно — такое явление называют самосборкой. Это — процесс, в котором небольшие молекулярные компоненты самопроизвольно соединяются вместе, образуя намного более крупные и сложные супрамолекулярные агрегаты. При самосборке энтропия системы уменьшается, ΔS < 0, поэтому для того, чтобы процесс был самопроизвольным, т. е. имел отрицательную энергию Гиббса:
ΔG = ΔH – TΔS < 0,
необходимо, чтобы ΔH < 0 и |ΔH| > |TΔS|. Это означает, что самосборка происходит с выделением большого количества теплоты. Главной движущей силой самосборки служит стремление химических систем к понижению энергии Гиббса путем образования новых химических связей, энтальпийный эффект здесь преобладает над энтропийным.
Основными классами супрамолекулярных соединений являются кавитанды, криптанды, каликсарены, комплексы «гость–хозяин», ротаксаны, катенаны, клатраты. К супрамолекулярным структурам можно также отнести мицеллы, липосомы, жидкие кристаллы.
Методы супрамолекулярной химии находят широкое применение в химическом анализе, медицине, катализе, фотохимии. Супрамолекулярные структуры — основа многих современных технологий, таких, как экстракция биологически активных веществ, создание фото- и хемосенсоров, молекулярных электронных устройств, разработка нанокатализаторов, синтез материалов для нелинейной оптики, моделирование сложных биологических процессов (биомиметика).
Иллюстрации
|
Рис. 1. Комплексы типа «хозяин–гость», образованные краун-эфирами и ионами щелочных металлов.
|
|
Рис. 2. Молекулярное распознавание с помощью водородных связей.
|
Автор
- Еремин Вадим Владимирович
Источники
- Лен Ж.-М. Супрамолекулярная химия. Концепции и перспективы. — Новосибирск: Наука, 1998. — 334 с.
- Стид Дж. В., Этвуд Дж. Л. Супрамолекулярная химия. — М.: Академкнига, 2007.
